医用镍钛合金是一种镍 / 钛原子比相近的金属间化合物,因其具有独特的形状记忆效应、优良的力学性能和生物相容性,是制作医疗植入器械的理想材料[1,2]。例如,在心血管支架方面,利用镍钛合金形状记忆效应制造的自膨胀型支架,避免了球囊扩张型支架在球囊撤出后径向回弹的问题,减少血管再狭窄发生[3];在外科矫形器械方面,镍钛合金弹性模量约为 67GPa,低于不锈钢和纯钛,更加接近皮质骨弹性模量,利于减轻因应力屏蔽产生的骨骼愈合缓慢等问题,广泛应用于髓内钉、加压接骨器、环抱内固定器和脊柱矫形棒等医疗器械。
镍钛表面存在 2~20nm 厚的 TiO2保护层,赋予镍钛良好的生物相容性以及耐腐蚀性,但这种自然氧化层通常不够致密,在生理环境长期腐蚀作用下,可能发生剥落或点蚀现象,导致镍离子释放进入细胞。镍离子含量过高可能会破坏细胞器,改变细胞形态,产生过敏、炎症等不良反应。此外,研究发现血管发生支架内再狭窄现象与镍离子的过量释放有关[4-6]。
镍钛合金本身是生物惰性材料,植入体与骨组织以机械嵌合方式连接,骨整合性能欠佳,同时面临着细菌感染等问题[7,8]。因此,需对镍钛合金进行表面改性,改善其耐腐蚀性,赋予其广谱抗菌、促成骨、抗凝血等多种生物学功能[9-11]。
本文综述了近年来医用镍钛合金表面改性研究进展,根据改性过程中涂层与基体是否发生化学反应,将改性方法归类为物理表面改性、化学表面改性及复合表面改性,重点介绍了各改性方法的改性机理、技术特点以及所得涂层的理化特性和生物学性能。
1、 物理表面改性
物理表面改性主要包括等离子喷涂、磁控溅射、等离子体浸没离子注入、激光表面改性以及电泳沉积,各改性方法制备的涂层及其特点详细介绍如下。
1.1 等离子喷涂
等离子喷涂(Plasma Spraying)是通过等离子电弧产生高温将材料熔化、熔融粒子沉积到基体表面形成涂层的表面改性技术,该方法操作简单、设备成本较低、沉积速率高,调节电弧功率、等离子体流速、喷涂时间等参数可以获得不同性质的涂层,可改善基体的耐腐蚀性、耐磨性等,但不适合结构复杂的表面改性。已有研究利用等离子喷涂技术沉积 ZrO 2[12]、羟基磷灰石Ca 10 (PO 4 )6 (OH) 2(HAP)[13,14] 等材料到植入体表面,提高其耐蚀性和生物相容性。
Prymak 等[15] 采用等离子喷涂技术在镍钛表面制备了羟基磷灰石涂层,呈典型的液滴固化形貌,涂层与基体结合强度良好,可以承受一定程度弯曲变形而不开裂。除了活性生物陶瓷,生物相容性优良的金属也被作为涂层材料。钽(Ta)[16] 喷涂到镍钛表面形成含微晶结构的涂层,在模拟体液中进行的电化学实验表明钽涂层显著提升镍钛耐腐蚀性能,电偶电流 - 时间曲线显示涂层与基体电流密度为微安级,几乎不发生电偶腐蚀。
1.2 磁控溅射
磁控溅射(Magnetron Sputtering)技术来源于强化放电理论,高真空条件下通入适量氩气,在电场作用下氩气电离并获得很高的能量,氩离子轰击靶材表面,靶材中的原子或分子溅射到基体表面形成特定功能涂层。磁控溅射技术具有沉积速率快、镀层紧密均匀、靶材种类多样等特点。
利用磁控溅射技术可在镍钛表面制备金属、合金以及陶瓷薄膜。Ji 等[17] 以锆为靶材,在镍钛表面溅射锆涂层,研究表明涂层表面平整,与基体结合紧密,晶体结构与靶材一致,并伴有少量 ZrO2陶瓷相。Yuan 等[18] 利用磁控溅射技术在镍钛表面沉积了一层 TiO2薄膜,研究表明改性后镍钛耐腐蚀性能明显提升,干细胞的粘附数量提高一倍。将材料植入兔子股骨,发现溅射 TiO2后,镍钛与骨组织结合更紧密,20d 后基本被新骨覆盖,没有骨折、水肿等不良反应,骨组织诱导能力比未改性镍钛高出9~10 倍。
1.3 等离子体浸没离子注入
等离子体浸没离子注入(Plasma ImmersionIon Implantation,PIII)是一种实现全方位均匀离子注入的表面改性技术,原理如图1 所示[19]。真空条件下,气体通过辉光放电离化提供等离子源,或固体靶材通过电弧离化产生等离子体,基体浸没在等离子体中,在基体上施加脉冲负高压,排斥电子,形成正离子鞘层,在鞘层电场作用下,正离子获得高能量,沿不同方向垂直、均匀地注入到基体表面。PIII技术能够单一或同时注入多种元素,改性层与基体结合紧密,没有明显界限,适合复杂形状材料的表面改性。
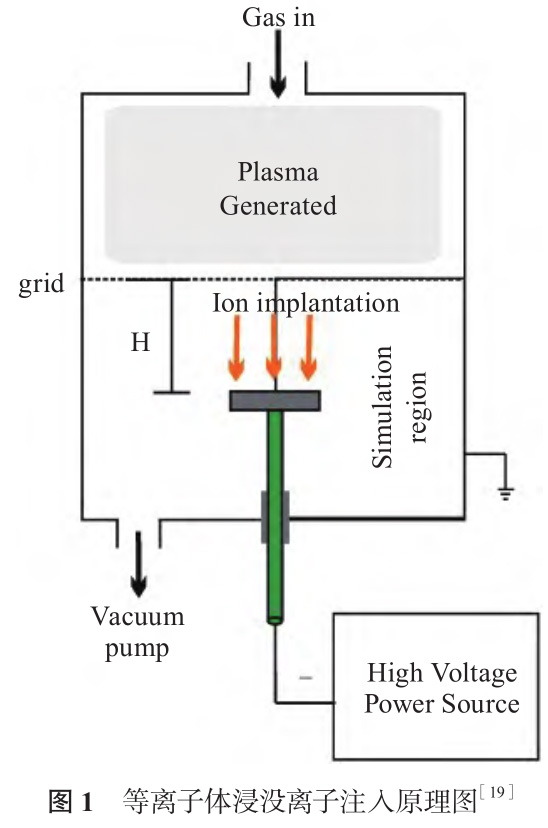
Maleki-Ghaleh 等[20] 研究了氮离子注入对镍钛表面生物学性能的影响。氮离子注入改性所得镍钛表面形成了TiN 和 Ti2N 相,且随着氮离子注入剂量增加,耐腐蚀性提高。氮离子注入量为1.4×10 18 ion/cm 2的改性镍钛表面耐蚀性最好,镍离子释放量最低。
增大注入量其耐蚀性反而下降,原因可能是高剂量注入时原子晶格应变量增加,基体产生较多表面应力,加速了电化学腐蚀反应。通过成纤维细胞培养评价改性镍钛的生物相容性,发现注氮镍钛为细胞粘附提供更多的活性位点,细胞铺展面积明显高于未改性镍钛。以 C2H2为碳源进行碳离子注入可制备 DLC 膜[21],可显著改善镍钛耐腐蚀性能,抑制镍离子析出,改性镍钛在汉克溶液中浸泡 20d 镍离子释放量接近于零,同时电化学腐蚀后表面仍保持平整。
金属材料常用作阴极靶材,注入到镍钛表面可赋予其特定生物学功能。Zhao 等[22] 采用 PIII 技术在镍钛表面注钽,镍离子释放量降低 40%,成骨细胞增殖程度提高,且呈现更好的黏附形态。Wu等[23] 采用 PIII 技术在镍钛表面注入铜和氮元素,形成 Cu 3 N/Cu 微电池对,实现优异的催化杀菌功能且具有良好的生物相容性。Wei 等[24] 采用两步PIII 法,在基体表面原位构建 Ni 3 N 薄膜,Ni 3 N 薄膜对金黄色葡萄球菌和大肠杆菌均具有 99% 以上的杀灭率。
1.4 激光表面改性
激光表面改性(Laser Surface Modifi cation)将激光技术与金属表面热处理结合,具有激光能量密度高、输出功率准确可控的特点。涂层材料被激光照射后发生重熔,并与基体结合,从而改善基体耐蚀性、表面硬度、生物相容性等表面理化性质。根据激光照射后涂层种类不同,常用于镍钛表面的激光表面改性技术可分为激光熔覆、激光氮化等。
激光熔覆是将涂层粉末提前喷涂到基体表面或与激光束同步送粉,粉末在激光束作用下快速熔化、扩散、凝固,生成无气孔、无裂纹的冶金结合界面的技术。Yang 等[10] 将钛粉与 HAP 粉末混合,均匀涂覆在镍钛表面,通过 Nd:YAG 激光器照射形成HAP/ 钛复合涂层。不同区域元素含量分析结果显示表层镍含量比基体降低了一半,有效降低镍离子释放。涂层浸没在汉克溶液中两周,表面产生磷灰石层,表明 HAP/ 钛复合涂层有效改善镍钛生物活性。
激光氮化是在氮气氛围中利用激光束熔化镍钛表面,凝固后形成致密的氮化钛改性层,Zhang 等[25] 据此制备了氮化钛涂层,显著改善镍钛耐腐蚀性。Ng等[26] 用蒸馏水、二碘甲烷和 RPMI 1640 培养基评价激光氮化处理后样品的亲水性,发现接触角均减小,这与氮化处理后表面能极性部分较高有关。亲水表面更利于细胞附着,心肌细胞培养 48 h 后呈纺锤状,铺展面积显著高于未改性镍钛。
1.5 电泳沉积
电泳沉积(Electrophoretic Deposition)是指待沉积材料粉末分散在胶体中,带电粒子在电场作用下定向移动(电泳),均匀沉积到电极表面形成薄膜。
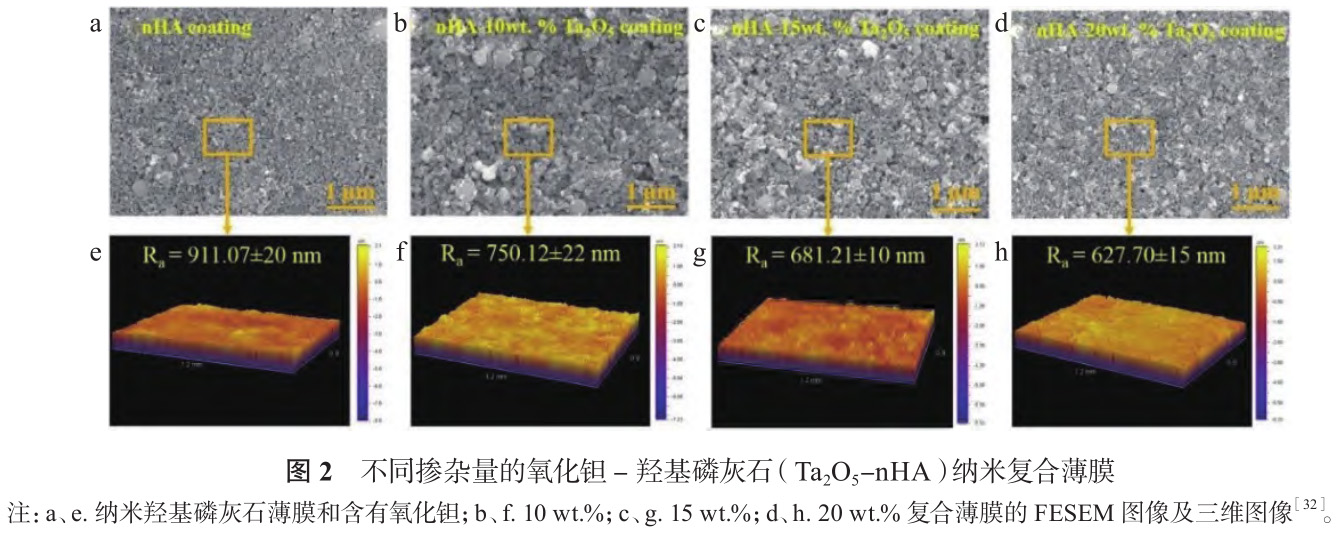
电泳沉积操作简单,设备成本低廉,制备条件温和,可防止薄膜发生脆裂或相变。电泳沉积被用于在金属表面制备耐腐蚀性薄膜或生物活性陶瓷涂层。Khalili 等 [27] 对镍钛进行喷砂、酸蚀预处理,增大表面粗糙度,采用电泳沉积制备的 HAP 涂层结合强度比未预处理镍钛提高50%。引入 TiO2和 Y2O 3 等活性金属氧化物第二相可改善其弹性模量、硬度等力学性能[28,29],克服 HAP 机械性能较差、负载条件下与基体结合强度不足等缺点[30,31]。Horandghadim 等[32] 利用电泳沉积在镍钛表面制备了不同掺杂量的氧化钽 - 羟基磷灰石(Ta2O 5 -nHA)纳米复合薄膜,如图2所示。沉积过程中 Ta2O 5 粒子填充薄膜孔隙,使表面愈加平整,填充量越高,平均粗糙度越低,薄膜越紧密,利于阻碍镍离子进入组织,20 wt.% Ta2O 5 -nHA 薄膜镍离子释放量比未改性镍钛减少 90%,弹性模量和硬度分别为(32.85±3.23)GPa 和(2.38±0.18)GPa,与骨骼力学性能接近,利于减轻植入体产生的应力屏蔽效应。
2、 化学表面改性
化学表面改性主要包括电化学沉积、阳极氧化、微弧氧化、溶胶- 凝胶法、化学气相沉积、水热法以及共价枝接,各类方法制备的涂层及其特点详细介绍如下。
2.1 电化学沉积
电化学沉积(Electrochemical Deposition)是指电场作用下离子迁移到电极表面发生氧化还原反应形成涂层的技术。Li 等[33] 将壳聚糖和硝酸银混合溶解到乙酸中作为电解液,在镍钛表面沉积了壳聚糖 / 银复合涂层,抑菌环实验结果显示壳聚糖 / 银复合涂层产生的抑菌环明显大于单一沉积银或壳聚糖,表明复合涂层具有协同抗菌效果。Hammad 等[34]以硝酸锌为电解液,采用三电极体系在镍钛正畸弓丝表面沉积氧化锌涂层。研究显示获得了稳定附着的氧化锌涂层,摩擦力比未改性镍钛弓丝降低 34%,涂层对金黄色葡萄球菌、化脓性葡萄球菌和大肠杆菌均具有显著抗菌活性。
2.2 阳极氧化
阳极氧化(Anodic Oxidation)是一个电化学反应过程,待处理金属连接阳极发生氧化反应,得到氧化层。氧化过程中阳极发生部分溶解,通常在中性或弱碱性电解液中得到致密氧化膜,在含 F - 、Cl - 的酸性电解液中形成多孔氧化层,是由于酸性条件下氧化层溶解速率加快,F - 、Cl - 在电场作用下对其具有刻蚀作用 [35] 。电解液种类、外加电流电压、反应温度和时间等对制得氧化膜的理化性质均具有重要影响。
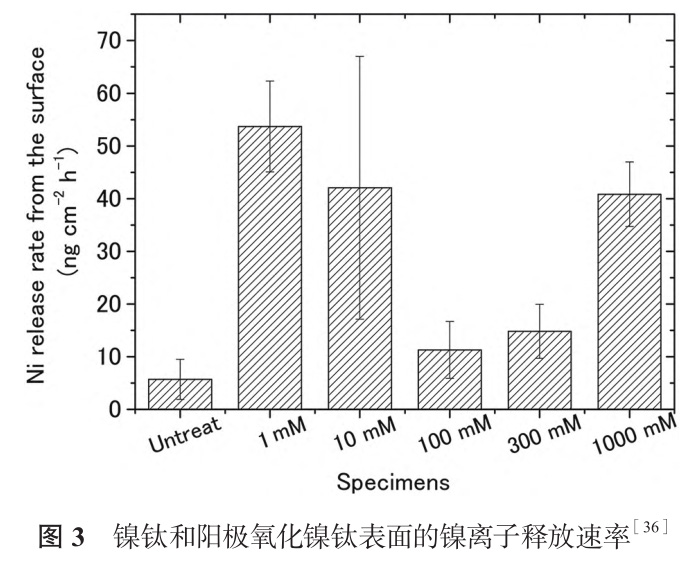
阳极氧化适合在 Ti、W、Zr、Hf、Ta 等少数几种金属表面构建纳米管结构,但由于镍钛合金含有 Ni 元素,纳米管的形成较为困难。Ohtste 等[36] 使用不同浓度的硝酸电解液对镍钛进行阳极氧化,制备纳米孔氧化层,纳米孔大小随硝酸浓度增加而增加,镍离子的释放量不是类似的线性关系,如图3所示。镍离子析出受氧化层厚度与表面孔隙率双重影响,硝酸浓度低于100mM 时,氧化层厚度占主导因素,氧化层厚度随硝酸浓度增加,镍离子释放量减少,浓度高于100mm 时,孔隙率占主导因素,浓度升高孔隙率增大,镍离子释放量增加。
为评估镍离子释放动力学行为对细菌、细胞生理活性的影响,Hang 等[37] 使用含 5.0 vol.% H2 O和 0.3mol NaCl 的乙二醇为电解液,施加 10V 电压在镍钛表面制备了长度从 0.55~114μm 的纳米孔氧化层。镍离子释放量与纳米孔长度成正比,当长度小于11μm 时,涂层呈良好的细胞相容性,长度大于11μm 时,涂层对细胞产生抑制作用,金葡菌抑菌率达到100%。值得注意的是,即使纳米孔长度为1μm,抑菌率也可达到 80%。
2.3 微弧氧化
微弧氧化(Miro-arc Oxidation)由阳极氧化发展而来,因此二者在技术上有相似之处,最大的区别就是微弧氧化外加电压更高,在金属表面产生火花放电现象,原位生成致密氧化膜。微弧氧化技术不需要在真空等特殊条件下进行,设备简单、工艺稳定,通过改变电解液组分、氧化时间、电极材料等调控氧化膜性能,制备出颜色各异、成分不同、具有特定生物学功能的氧化膜。Yesildal 等[38] 配 制了含 NaAlO2 、NaH2PO2和Na2SO 4 的 NaOH 电解液,pH 调至11,采用微弧氧化技术在镍钛表面制备出厚度均匀的 TiO2涂层。模拟体液中浸泡 21d 后发现,未改性镍钛表面析出的镍离子总量随时间逐渐增加,并在第21天达到最大值,微弧氧化后镍钛合金释放的镍离子浓度在 21d 内均低于检测限。差热法结果显示未改性镍钛在模拟体液中浸泡 21d 后重量增加 0.071g,镍钛经过微弧氧化处理后,重量增加 0.6619g,表面覆盖类骨结构磷灰石。
2.4 溶胶- 凝胶法
溶胶 - 凝胶(Sol-gel)反应过程包括以下四步[39]:①高反应活性前驱体(金属醇盐是最常用的金属基前驱体)通过水解反应得到水和醇盐的均相溶液;②溶液中的水解分子发生缩聚反应,形成溶胶;③胶体粒子进一步缩聚构成三维网络,形成凝胶;④热处理除去凝胶内的溶剂,得到多孔或致密涂层。溶胶- 凝胶法制备过程简单灵活,涂层厚度可控,几乎不改变基体原始形貌,不同反应物之间可能在分子水平上均匀混合,在合成纳米复合涂层方面有独特优势。
Fu 等[40] 用 NaOH、HCl 先后对镍钛进行预处理构建钛酸盐多孔层,将其作为中间层,然后将钛酸四丁酯、二乙醇胺溶解在乙醇中得到前驱体溶液,控制浸渍-干燥次数调控 TiO2涂层厚度。研究表明,在抛光镍钛表面,浸渍-干燥2次即产生明显裂纹,可能由于涂层干燥过程中体积收缩导致。预制备多孔中间层后,钛酸盐 /TiO2多孔网络在热处理过程中发生致密化、结晶化[41],界面互锁促进 TiO2涂层附着。钽具有优良的血液相容性,Dong 等[42] 在前驱体溶液中引入乙醇钽,制备不同钽 / 钛原子比的 Ta-TiO2涂层。血小板黏附实验结果显示 TiO2涂层表面大量血小板聚集,形成团块,添加钽后只有少量血小板黏附,且形状基本呈圆形,表明血液相容性得到改善。
2.5 化学气相沉积
化 学 气 相 沉 积(Chemical Vapor Deposition,CVD)可以简单理解为高温下气相反应物发生解离,通过化学反应在基体上形成固态薄膜的过程。反应温度取决于成膜物质种类,化学气相沉积过程中引入等离子体可以激发气体分子,降低反应温度,同时加速反应物在基体表面的扩散速率,提高成膜速率与薄膜均匀程度[43]。
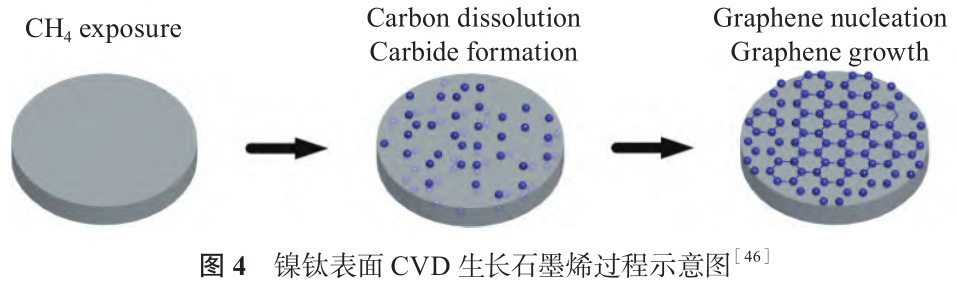
石墨烯是碳原子通过 sp2杂化方式结合形成的蜂窝状二维材料,其诱导干细胞成骨分化的能力在生物工程领域引起很多关注[44,45]。CVD 法将含碳前驱体分解为碳原子,沉积到基体后成核、生长形成石墨烯,操作简单、参数可控,是大面积制备石墨烯薄膜的有效方法。Li 等[46] 以甲烷为碳源,采用CVD 法在镍钛表面原位合成石墨烯薄膜,研究其形成机理。如图 4 所示,由于钛对碳的亲和性比镍高,镍钛表面形成碳化钛,溶解度逐渐达到饱和,降温时碳的溶解度降低,从基体析出形成石墨烯薄膜,碳化钛的(111)晶面更利于石墨烯生长。
2.6 水热法
水热法(Hydrothermal Treatment)是指加热密闭反应容器产生高温高压环境,以水溶液为反应介质,使难溶反应物溶解、重结晶生成目标产物。水热法简单方便,通过改变反应温度、反应时间、前驱体种类及浓度、添加生长调节剂(极性有机分子等)可调控产物的粒径、形态[47]。
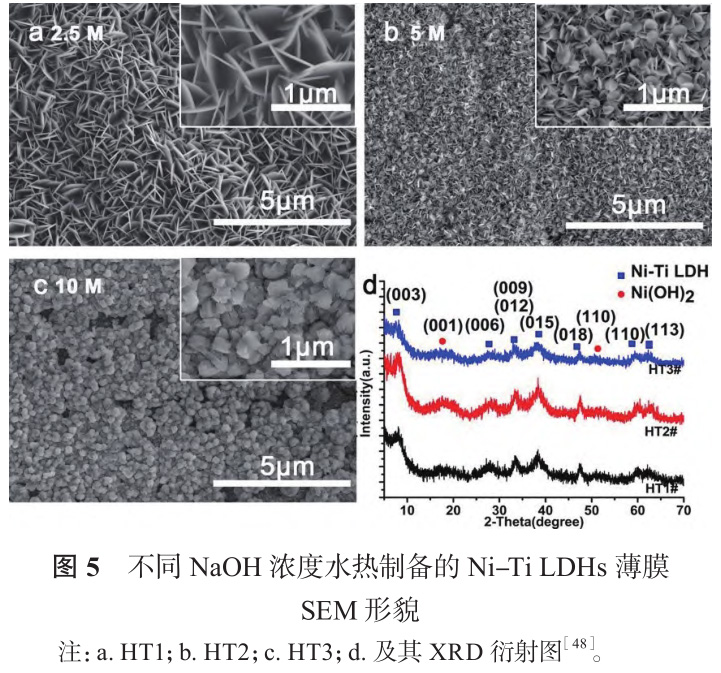
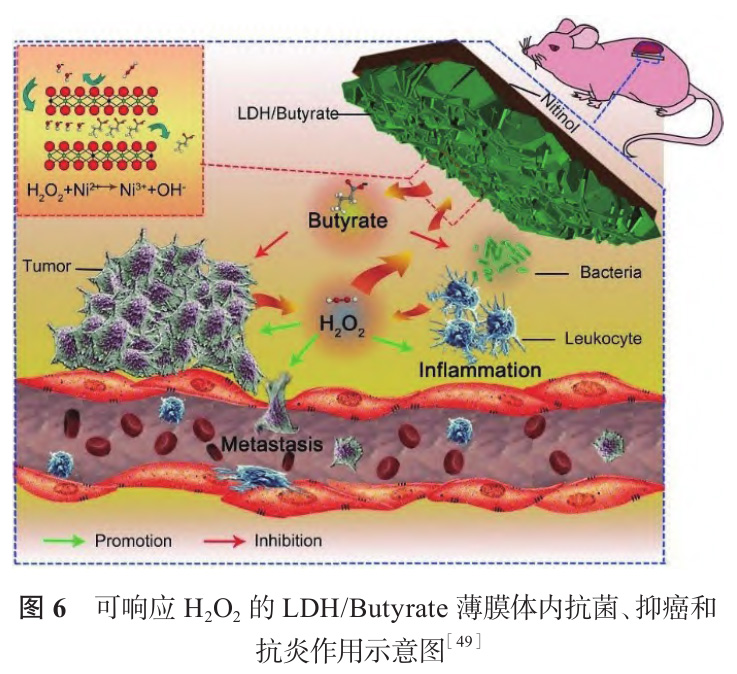
Wang 等[48] 在 NaOH 溶液中采用水热处理制备了一系列不同镍钛比的镍钛层状双氢氧化物薄膜(Ni-Ti LDH)。如图 5 所示,随着 NaOH 浓度升高,纳米片逐渐倾倒、聚集,最终形成颗粒。薄膜对肿瘤细胞具有选择性抑制作用,由于肿瘤细胞微环境呈弱酸性,Ni-Ti LDH 分解释放镍离子,进入肿瘤细胞引起氧化应激,造成其凋亡。Wang 等[49] 以NiCl2、TiCl 4 和尿素混合液为前驱体,在镍钛表面合成含 CO 3 2- 和 CNO - 的 Ni-Ti LDH,并通过离子交换将抗肿瘤药物丁酸根(Butyrate)负载于 LDH 板层间,构建一个环境响应型抗菌抗肿瘤平台(LDH/Butyrate),机理如图 6 所示。肿瘤组织与细菌感染微环境富含 H2O2,LDH/Butyrate 可与 H2O2反应释放丁酸根,实现抗菌抗肿瘤的目的,同时组织内 H2O 2浓度降低,有利于抑制肿瘤细胞转移、缓解炎症反应。
2.7 共价枝接
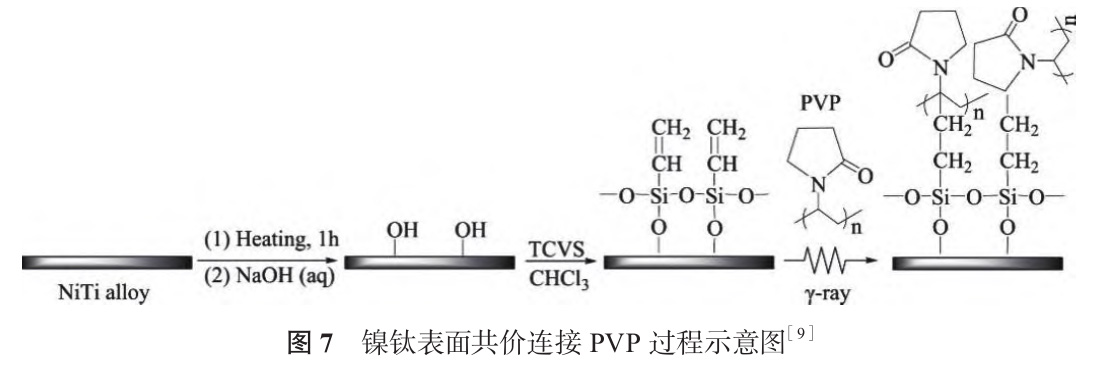
共价枝接(Covalent Grafting)是将涂层分子通过共价键固定到基体表面的改性方法,常用于金属表面改性的枝接分子包括有机硅烷、聚乙二醇、多巴胺 / 聚多巴胺等[50,51]。Yu 等[9] 将预氧化的镍钛浸泡在三氯乙烯硅烷(TCVS)中进行硅烷化,通过γ-射线辐射将 PVP 枝接到镍钛表面,如图 7 所示。固定 PVP 后,样品亲水性显著提高,蛋白质吸附量明显减少。γ- 射线辐射过程中,TCVS 携带的乙烯基电离形成乙烯基自由基,聚乙二醇携带的烷基电离形成自由基后可与乙烯基自由基连接形成共价键,从而在硅烷化表面固定聚乙二醇,改善镍钛亲水性,促进成骨细胞增殖[52]。
3、 复合表面改性
单一改性方法存在一定的局限性,可能无法完全满足临床需求,为了优化镍钛表面性能,制备多功能生物涂层,需结合多种方法进行表面改性。Liu 等[53]发现经过水热处理纳米孔转变为纳米线,延长水热时间未对表面形貌产生明显影响,相比纳米孔和未处理镍钛,间充质干细胞在在纳米线表面增殖速率最快。
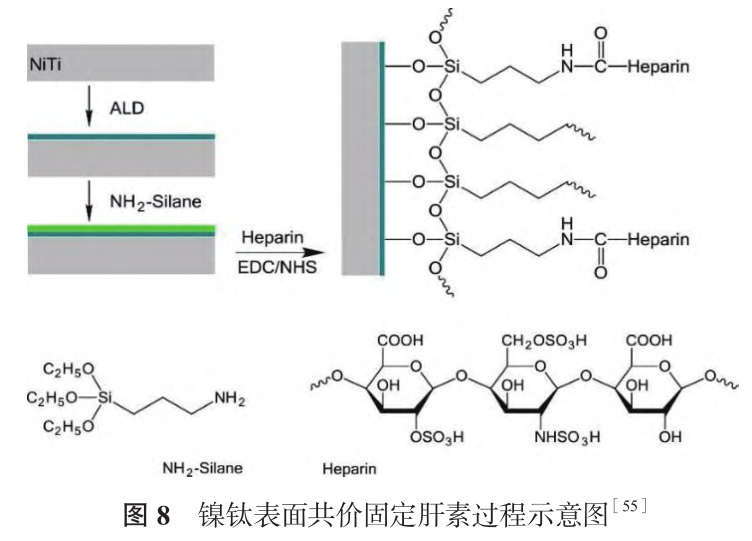
Viswanathan 等[54] 先采用 PIII 技术将氧气注到镍钛表面,再利用阳极氧化将涂层氧含量增加至 94.3at.%,未处理镍钛表面氧含量为 75.9at.%,极化曲线结果表明高含氧量涂层呈现更好的耐腐蚀性能。肝素是天然抗凝血剂之一,表面肝素化是血液接触材料常用的改性策略。如图 8 所示,Wang 等[55]采用原子层沉积技术在镍钛表面沉积一层10nm 厚的氧化铝中间层,再依次用偶联剂 3- 氨基丙基三乙氧基硅烷(NH2-Silane)和肝素对氧化铝覆盖的表面进行改性。通过甲苯胺蓝法评价肝素的稳定性,将涂层浸入 PBS 中,肝素初始密度为(2.27±0.05)μg/cm2,37℃振荡 30d 后密度为(1.96±0.05)μg/cm2,考虑到肝素本身是一种水溶性聚合物,表明共价枝接后涂层可以稳定存在。由于肝素与水分子通过氢键和静电作用形成水合层,抑制蛋白质吸附,涂层表面纤维蛋白原吸附量和血小板聚集量明显少于未改性镍钛,改性前后镍钛表面内皮细胞密度、形态没有显著差异,表明涂层改性未产生细胞毒性。
4、 总结与展望
医用镍钛合金表面镍离子的过量释放和生物惰性是制约其临床使用效果的两大关键问题,对其进行表面改性可在保留基体优良力学性能的同时提高其生物安全性、赋予其生物学功能。本文将常用的表面改性方法分为物理表面改性、化学表面改性及复合改性,概述各类方法的改性机理和优缺点,结合最新研究进展介绍各改性技术对于镍钛表面的作用机制,以及由此制备的具有特定功能的改性涂层;并深入分析改性涂层的化学组成、结合强度、粗糙度等理化性质与制备工艺之间的联系,阐述改性涂层对组织细胞的影响规律及作用机制。
尽管已有多种工艺技术用于镍钛合金表面改性,各表面改性方法构建的涂层均存在一定局限。例如:等离子喷涂涂层与基体热膨胀系数相差较大,可能产生较高残余应力,降低涂层结合强度,且不适合表面结构复杂的基体;等离子浸没注入技术改性层较薄,只有 100nm 左右,生产成本较高;溶胶凝胶法制备的涂层与基体结合强度不足,特别是干燥和热处理过程中涂层体积收缩可能引发裂纹;生长因子、多肽等生物分子价格较高,稳定性较差,共价枝接到材料表面通常会影响其生物活性。因此,需根据临床需求慎重选择表面改性方法,充分发挥技术优势,避免或减轻负面影响。
对医用镍钛合金进行表面改性可有效改善其耐蚀性和生物相容性,赋予其抗菌、成骨、促内皮修复等生物学功能,但仍有许多问题需要重点关注。例如,人体不同部位对植入体有具体功能要求,需开发特定功能的生物安全涂层;涂层在动物和人体中与组织响应情况不同,暂时缺乏系统的临床研究;此外,植入物在体内常处于负载状态,目前对涂层抗疲劳
性能的研究仍较少。未来需更加科学全面地分析涂层理化性能对组织细胞的影响规律,为医用镍钛合金进一步临床应用提供理论基础。
[ 参 考 文 献 ]
[1] Mantovani D. Shape memory alloys properties and biomedical applications[J]. J Met, 2000, 52(10):36-44.
[2] Otsuka K, Ren X. Physical metallurgy of Ti–Ni-based shape memory alloys[J]. Prog Mater Sci, 2005, 50(5):511-678.
[3] Duerig TW, Tolomeo DE, Wholey M. An overview of superelastic stent design[J]. Minim Invasiv Ther 2000, 9(3-4):235-246.
[4] Hillen U, Haude M, Erbel R, et al. Evaluation of metal allergies in patients with coronary stents[J]. Contact Dermatitis, 2002, 47(6):353-356.
[5] Gristina AG. Biomaterial-centered infection-microbial adhesion versus tissue integration [J]. Science, 1987, 237(4822):1588-1595.
[6] Rae T. Study on effects of particulate metals of orthopedic interest on murine macrophages invitro[J]. J Bone Joint Surg Br, 1975, 57(4):444-450.
[7] Bergergorbet M, Broxup B, Rivard C, et al. Biocompatibility testing of NiTi screws using immunohistochemistry on sections containing metallic implants[J]. J Biomed Mater Res, 1996, 32(2):243-248.
[8] Takeshita F, Takata H, Ayukawa Y, et al. Histomorphometric analysis of the response of rat tibiae to shape memory alloy (nitinol)[J]. Biomaterials, 1997, 18(1):21-25.
[9] Yu H, Liu Y, Wang Y, et al. A study on poly (N-vinyl-2-pyrrolidone) covalently bonded NiTi surface for inhibiting protein adsorption[J]. Prog Nat Sci: Mater Int, 2016, 26(6):584-589.
[10] Yang S, Li WH, Man HC. Laser cladding of HA/Ti composite coating on NiTi alloy[J]. Surf Eng, 2013, 29(6):409-413.
[11] Say Y, Aksakal B. Silver/Selenium/Chitosan-doped Hydroxyapatite coatings on biological NiTi alloy: In vitro biodegradation analysis[J]. J Sol-Gel Sci Technol, 2019, 90(2):434-442.
[12] Chou BY, Chang E. Influence of deposition temperature on mechanical properties of plasma-sprayed hydroxyapatite coating on titanium alloy with ZrO2intermediate layer[J]. J Therm Spray Technol, 2003, 12(2):199-207.
[13] Garcia-Alonso D, Parco M, Stokes J, et al. low-energy plasma spray (leps) deposition of hydroxyapatite/poly-epsilon-caprolactone biocomposite coatings[J]. J Therm Spray Technol, 2012, 21(1):132-143.
[14] Gu YW, Khor KA, Pan D, et al. Activity of plasma sprayed yttria stabilized zirconia reinforced hydroxyapatite/Ti-6Al-4V composite coatings in simulated body fluid[J].Biomaterials, 2004, 25(16):3177-3185.
[15] Prymak O, Bogdansk D, Esenwein SA, et al. NiTi shape memory alloys coated with calcium phosphate by plasma-spraying. Chemical and biological properties[J].Materialwiss Werkst, 2004, 35(5):346-351.
[16] 尹大宇,朱锦宇,段永宏. 生物医用镍钛合金表面钽涂层腐蚀行为研究[J]. 华南国防医学杂志,2011,25(1):52-56.
[17] Ji H, Chu C, Wang R, et al. Preparation of zirconium fi lm on NiTi shape memory alloy surface by magnetron sputtering and investigation of its structure[J]. Rare Metal Mat Eng, 2009,38(2):295-298.
[18] Yuan B, Li H, Gao Y, et al. In vitro and in vivo evaluation of porous NiTi alloy modified by sputtering a surface TiO2fi lm[J]. Sci China-Technol Sc, 2012, 55(2):437-444.
[19] Chu PK. Progress in direct-current plasma immersion ion implantation and recent applications of plasma immersion ion implantation and deposition[J]. Surf Coat Tech, 2013, 229:2-11.
[20] Maleki-Ghaleh H, Khalil-Allafi J, Sadeghpour-Motlagh M, et al. Effect of surface modification by nitrogen ion implantation on the electrochemical and cellular behaviors of super-elastic NiTi shape memory alloy[J]. J Mater Sci-Mater M, 2014, 25(12):2605-2617.
[21] Sui JH, Cai W. Formation of diamond-like carbon (DLC)fi lm on the NiTi alloys via plasma immersion ion implantation and deposition (PIIID) for improving corrosion resistance[J].Appl Surf Sci, 2006, 253(4):2050-2055.
[22] Zhao T, Yang R, Zhong C, et al. Effective inhibition of nickel release by tantalum-implanted TiNi alloy and its cyto-compatibility evaluation in vitro[J]. J Mater Sci, 2011, 46(8):2529-2535.
[23] Wu L, Tan J, Chen S H, et al. Catalyst-enhanced micro-galvanic effect of Cu 3 N/Cu-bearing NiTi alloy surface for selective bacteria killing[J]. Chem Eng J, 2022, 447:137484.
[24] Wei C, Zhang HF, Tan J, et al. Nickel nitride-mediated nitric oxide generation for combating implant-associated infections[J].Chem Eng J, 2024, 490:151566.
[25] Zhang S, Tang H, Hu F, et al. Electrochemical corrosion behavior of laser gas nitrided layer on the NiTi shape memory alloy in Hank’s solution[C]. Mater Manuf, Pts 1 and 2,2011:179-182.
[26] Ng CH, Rao N, Law WC, et al. Enhancing the cell proliferation performance of NiTi substrate by laser diff usion nitriding[J]. Surf Coat Tech, 2017, 309:59-66.
[27] Khalili V, Naji H. Developing a mechanochemical surface pretreatment to increase the adhesion strength of hydroxyapatite electrophoretic coating on the NiTi alloy as a bone implant[J].Surf Coat Tech, 2020, 397:125985.
[28] Farnoush H, Mohandesi JA, Cimenoglu H. Micro-scratch and corrosion behavior of functionally graded HA-TiO2nanostructured composite coatings fabricated by electrophoretic deposition[J]. J Mech Behav Biomed, 2015,46:31-40.
[29] Parente P, Sanchez-Herencia AJ, Mesa-Galan MJ,et al. Functionalizing Ti-Surfaces through the EPD of Hydroxyapatite/NanoY2O 3 [J]. J Phys Chem B, 2013, 117(6):1600-1607.
[30] Laonapakul T, Nimkerdphol AR, Otsuka Y, et al. Failure behavior of plasma-sprayed HAp coating on commercially pure titanium substrate in simulated body fl uid (SBF) under bending load[J]. J Mech Behav Biomed, 2012, 15:153-166.
[31] Vladescu A, Padmanabhan SC, Azem FA, et al. Mechanical properties and biocompatibility of the sputtered Ti doped hydroxyapatite[J]. J Mech Behav Biomed, 2016, 63:314-325.
[32] Horandghadim N, Khalil-Allafi J, Urgen M. Influence of tantalum pentoxide secondary phase on surface features and mechanical properties of hydroxyapatite coating on NiTi alloy produced by electrophoretic deposition[J]. Surf Coat Tech,2020, 386:125458.
[33] Li P, Zhang X, Xu R, et al. Electrochemically deposited chitosan/Ag complex coatings on biomedical NiTi alloy for antibacterial application[J]. Surf Coat Tech, 2013, 232:370-375.
[34] Hammad SM, El-Wassefy NA, Shamaa MS, et al. Evaluation of zinc-oxide nanocoating on the characteristics and antibacterial behavior of nickel-titanium alloy[J]. Dental Press J Orthod, 2020, 25(4): 51-58.
[35] Guan D, Fang H, Lu H, et al. Preparation and doping of anodic TiO2nanotube array[J]. Prog Chem, 2008, 20(12):1868-1879.
[36] Ohtste N, Hirano Y, Yamaguchi K, et al. Surface characteristics, Ni ion release, and antibacterial efficacy of anodized NiTi alloy using HNO 3 electrolyte of various concentrations[J]. Appl Surf Sci, 2019, 492:785-791.
[37] Hang R, Liu Y, Bai L, et al. Length-dependent corrosion behavior, Ni 2+ release, cytocompatibility, and antibacterial ability of Ni-Ti-O nanopores anodically grown on biomedical NiTi alloy[J]. Mat Sci Eng C-Mater, 2018, 89:1-7.
[38] Yesildal R, Karabudak F, Sukuroglu EE, et al. Differential scanning calorimetry (DSC) and Ni 2+ release analysis of NiTi-shape-memory dental alloys coated by micro-arc oxidation (MAO) method[J]. Appl Phys A-Mater, 2018,124(8):572.
[39] Livage J, Henry M, Sanchez C. Sol-gel chemistry of transition-metal oxides[J]. Prog Solid State Chem, 1988, 18(4):259-341.
[40] Fu T, Liu B G, Zhou Y M, et al. Sol-gel titania coating on NiTi alloy with a porous titania fi lm as interlayer[J]. J Sol-Gel Sci Technol, 2011, 58(1):307-311.
[41] Kokubo T, Kim HM, Kawashita M, et al. Bioactive metals:preparation and properties[J]. J Mater Sci-mater M, 2004,15(2):99-107.
[42] Dong B-H, Wu F, Alajmi Z, et al. Sol-gel derived Ta-containing TiO2fi lms on surface roughened NiTi alloy[J].Rare Metals, 2014, 33(1):21-27.
[43] Zhang XM, Qiu JJ, Tan J, et al. In-situ growth of vertical graphene on titanium by PECVD for rapid sterilization under near-infrared light[J]. Carbon, 2022, 192:209-218.
[44] Kostarelos K, Novoselov KS. Exploring the interface of graphene and biology[J]. Science, 2014, 344(6181):261-263.
[45] Luo Y, Shen H, Fang Y, et al. Enhanced proliferation and osteogenic differentiation of mesenchymal stem cells on graphene oxide-incorporated electrospun poly(lactic-co-glycolic acid) nanofi brous mats[J]. Acs Appl Mater Inter,2015, 7(11):6331-6339.
[46] Li J, Wang G, Geng H, et al. CVD growth of graphene on NiTi alloy for enhanced biological activity[J]. Acs Appl Mater Inter, 2015, 7(36):19876-19881.
[47] Canu G, Buscaglia V. Hydrothermal synthesis of strontium titanate: thermodynamic considerations, morphology control and crystallisation mechanisms[J]. Crystengcomm, 2017,19(28):3867-3891.
[48] Wang D, Ge N, Li J, et al. Selective tumor cell inhibition eff ect of Ni-Ti layered double hydroxides thin fi lms driven by the reversed pH gradients of tumor cells[J]. Acs Appl Mater Inter, 2015, 7(15):7843-7854.
[49] Wang D, Peng F, Li J, et al. Butyrate-inserted Ni-Ti layered double hydroxide fi lm for H2O2-mediated tumor and bacteria killing[J]. Mater Today, 2017, 20(5):238-257.
[50] Simsekyilmaz S, Liehn EA, Weinandy S, et al. Targeting in-stent-stenosis with RGD- and CXCL1-coated mini-stents in mice[J]. PLoS One, 2016, 11(5):e0155829.
[51] Sargeant TD, Rao MS, Koh CY, et al. Covalent functionalization of NiTi surfaces with bioactive peptide amphiphile nanofi bers[J]. Biomaterials, 2008, 29(8):1085-1098.
[52] Yu H, Yan J, Ma H, et al. Creating poly(ethylene glycol) fi lm on the surface of NiTi alloy by gamma irradiation[J].Radiat Phys Chem, 2015, 112:199-202.
[53] Liu S, Zhao Y, Liu Y, et al. Preparation and cytocompatibility of Ni-Ti-O nanospindles on NiTi alloy[J]. Mater Lett, 2019, 257:126697.
[54] Viswanathan S, Mohan L, Bera P, et al. Effect of oxygen plasma immersion ion implantation on the formation of nanostructures over Ni-Ti alloy[J]. Rsc Adv, 2016, 6(78):74493-74499.
[55] Wang F, Zhang Y, Chen XM, et al. ALD mediated heparin grafting on nitinol for self-expanded carotid stents[J].Colloid Surface B, 2016, 143:390-398.
无相关信息


sxxlti.com
旭隆金属手机网